在无菌药品生产中,每一个细节都可能影响到最终产品的质量与安全。尤其是粉针剂分装过程中,玻璃瓶口上方的分装机是否会影响气流流型,进而破坏“首过气流保护”,成为许多药企关注的核心问题。气流保护不仅是技术层面的要求,更是法规合规的关键环节。一旦忽视,可能导致产品污染、监管缺陷甚至市场召回,因此理解其原理并落实控制措施至关重要。

首过气流(First Air)是指从高效空气过滤器送出、未经任何干扰的洁净空气。这股气流如同“无菌屏障”,直接覆盖产品的关键暴露区域(如粉针剂的瓶口),有效阻隔微粒和微生物的污染。在无菌工艺中,首过气流是防止污染的第一道防线,其流型的稳定性和覆盖范围直接关系到产品的无菌保证水平。
根据FDA的GMP规范(如21 CFR Part 211.42)及相关行业指南,无菌操作区域必须设计为单向流(例如垂直或水平层流),并确保气流路径不受任何设备或物体的阻挡。如果气流受到干扰,可能导致湍流或阴影区域,使得关键点无法持续获得洁净空气的保护,从而构成严重的合规风险。
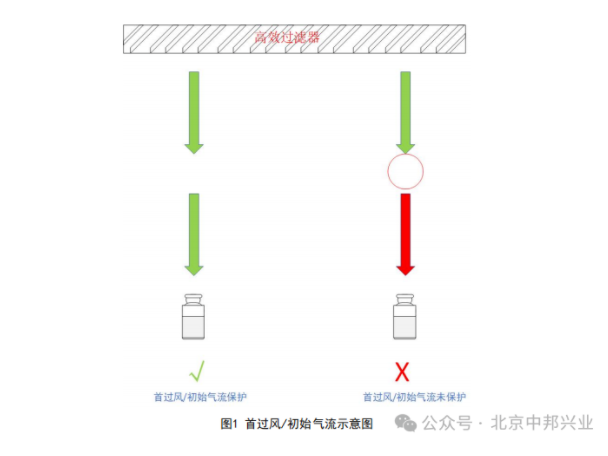
在粉针剂分装过程中,分装机通常位于玻璃瓶口上方,执行粉末填充任务。然而,其物理位置很可能被监管机构视为“气流遮挡物”。具体原因包括:
- 气流路径中断:分装机的机械结构可能阻挡层流的直接下行,导致气流在瓶口周围形成阴影或湍流,使该区域无法持续获得首过气流的保护。
- 关键点暴露风险:玻璃瓶口是产品直接暴露于环境的关键点,任何气流的不稳定性都可能增加微粒或微生物污染的风险。
FDA明确强调:气流保护的核心目标是产品接触点(即瓶口),而非设备本身。因此,将分装机和玻璃瓶视为整体的观点并不被监管接受。企业必须通过实际测试证明气流能够无阻碍地覆盖瓶口,否则可能面临483缺陷项或警告信。

历史检查案例显示,分装机对气流的遮挡问题多次被FDA列为重点缺陷:
- 2020年警告信案例:某药企因分装机位置不当,导致瓶口上方气流中断,形成阴影区。FDA在483报告中明确指出“设备放置未能确保首过气流保护关键区域”,要求企业重新设计设备布局并完成气流验证。
- 2019年检查案例:另一家企业因分装机设计导致局部湍流,被要求全面评估气流流型,并修改设备安装方案。
核心启示:仅凭理论分析无法证明气流的有效性。企业必须通过烟雾测试、粒子监测等可视化手段,实证气流能够直接覆盖瓶口,否则分装机很可能被认定为违规遮挡。
若分装机被质疑遮挡气流,建议企业从多维度开展整改:
- 立即行动:暂停存在风险的分装操作,防止污染风险进一步扩大。
- 气流测试验证:通过烟雾试验、粒子计数器等工具,可视化气流路径,确认瓶口是否处于有效保护范围内。
- 设备优化改造:调整分装机的高度、角度或加装气流导向装置,确保其与层流气流兼容。
- 系统再验证:重新执行安装确认、运行确认和性能确认,确保设备在无菌环境中的适用性。
- 人员培训与行为规范:加强操作人员对气流保护原理的培训,确保其严格执行操作规程,避免因人为操作加剧气流干扰。
- 环境监控升级:增加洁净室的微粒和微生物采样点及频率,实现对气流保护效果的持续监控。
- 根源分析与预防:通过根本原因分析,识别是设备设计、验证不足还是维护不当导致的问题,并制定长期预防措施。
气流遮挡问题往往是系统性质量风险的“冰山一角”。在调查过程中,企业还可能发现以下潜在问题:
- 设备维护缺陷:如校准过期、部件老化未及时更换。
- 环境监控不足:采样点设置不合理、监控频率不符合要求。
- 培训体系薄弱:员工对GMP要求理解不深,操作不规范。
- 数据完整性风险:历史气流测试记录不完整或存在篡改嫌疑。
- 供应商管理漏洞:玻璃瓶等物料的供应商未经过充分审计,可能引入污染风险。
通过多维度深挖,企业能够从根本上完善质量管理体系,避免“头痛医头、脚痛医脚”的被动局面。
- 分装机若位于瓶口上方,很可能被视为气流遮挡,需通过实证测试验证其合规性。
- 企业应主动开展气流流型研究,确保首过气流无阻碍覆盖所有关键点。
- 建议将气流保护要求纳入质量体系的日常监控与审核机制,形成长效管理。
温馨提示:如果您企业正面临类似问题,建议keyi,结合具体生产场景制定整改方案。只有将“气流守护”落到实处,才能在确保合规的同时,保障产品的无菌质量,降低监管风险。















