隔离技术旨在安全处理放射性物质,确保操作人员的安全[1]。自20世纪80年代起,隔离技术的运用范围显著扩大。起初,无菌检查隔离器在欧洲实验室中崭露头角,它通过营造稳定的环境条件,有效防止微生物对测试样本的污染,进而降低了假阳性结果的出现率;随后,无菌隔离系统逐渐渗透至食品、制药等多个工业领域,并得到了广泛应用。
目前,国际上常用的隔离系统主要有限制进出屏障系统 (restricted access barrier system,RABS) 和无菌隔离器 (isolator) 等 。
相较而言,无菌隔离器的优势明显,因其采用完全密闭的系统将生产空间与周围环境和操作人员完全隔离,可保护产品免遭环境污染 ( 包括来自操作人员在过滤和密封时带来的污染 )。此外,无菌隔离器配备的单独高效过滤器、空气处理系统和无菌隔离器集成气化过氧化氢灭菌系统,可自动控制无菌隔离器中的生产环境条件。通过阴性分数法或过度杀灭法证实灭菌隔离器可以使微生物数降至 10–6 ,而在传统洁净室内,微生物数只能控制在 10–3 的水平 。

《中华人民共和国药典》2020年版(ChP 2020)四部通则9206中,针对无菌检查法提出了具体的要求,并配套制定了无菌检查用隔离系统的验证及应用指导原则,为无菌隔离器的验证工作提供了规范。这些指导原则的发布,激发了众多验证技术研究的兴起。在无菌产品的质量研究中,已明确多个环节如生产区设计布局、生产设备环境、物料污染状况、人员操作及卫生等,均对最终产品质量至关重要。然而,现有研究大多聚焦于设计布局与物料状态,对人员操作因素的影响探讨相对较少。
针对冻干制剂呈粉状、易通过呼吸危害人体的特性,以及灌装过程中可能因操作不当导致的污染问题,对无菌隔离器内的操作进行了精细设计与严格验证。冻干制剂的微粒性质使其具有潜在的健康风险,因此,我们特别规定:
(1) 操作人员在无菌隔离器内的所有动作均须保持平稳,避免幅度过大或速度过快;
(2) 手套的使用必须严格限制,不得接触任何与工艺操作无关的表面。这些规定已明确纳入车间的标准操作规程中。
为确保操作人员遵守上述规范,并验证其操作是否符合文件要求,遵循相关法规,定期开展无菌工艺模拟测试和气流流型测试。在每次测试前,均确保无菌隔离器内部清洁合格,并排除前次操作对验证结果的任何潜在影响。通过这些措施,致力于保障冻干制剂的生产安全与产品质量。

要保证操作人员在无菌隔离器内的操作规范性,需先对操作人员在无菌隔离器内的操作内容进行严格设计。设计内容应包含操作人员在无菌隔离器内日常生产时的操作,以及无菌隔离器内设备出现异常时的操作,并确保所有干预操作均是实际生产中可能出现的,不进行不合理干预 。

每批生产均会发生的、正常的、有计划的生产工艺本身固有的干预操作汇总见表 1,包括无菌隔离器内的环境监测、过渡部位对接、在线称重、取样等。纠正性干预操作 ( 即在生产过程中进行纠正或调整的操作 ) 汇总见表 2,包括无菌隔离器使用过程中可能发生的情况,如倒瓶、炸瓶、碎瓶、传感器异常和针头调节等。
气流流型测试是指通过将无菌隔离器内的气流可视化,来验证设备运行和人员操作是否会对流型产生影响。具体测试方法为有资质的验证人员使用烟雾发生器进行测试。在确保无菌隔离器处于关闭状态后,验证人员将设置好的烟雾发生器连接发烟管、调整方向,对准工作区域上方、均流膜下方 30 cm 处,启动烟雾发生器,使烟雾进入气流并随气流流动。

传统的洁净室设计通常在关键区域采用单向流的方式,并且在靠近打开的无菌产品和容器的地方通常要求尘埃粒子符合 A 级洁净度级别,以减少产品和人员污染。根据《医药工业洁净厂房设计规范》和《药品生产质量管理规范 (2010 年修订 )》附录 1 无菌药品的要求 [12—13],A 级洁净区采用单向流。然而,能否控制洁净区内的空气洁净度,气流的影响较大。无菌隔离器内为 A 级环境,能否在日常生产中一直维持其内部的单向流对环境洁净度、产品质量有重要影响。该测试会使用摄像设备全程记录生产过程中的烟雾流动方向。测试过程中,无菌隔离器内设备处于正常生产状态,人员在各个岗位进行模拟干预操作,模拟操作方法见表 1、表 2。通过是否引起紊流或空气停滞等异常状态来验证人员在无菌隔离器内的操作是否规范。
APS 是指使用大豆胰蛋白胨液体培养基来代替药品进行生产。因为在大多数情况下,微生物在培养基中的生长繁殖要远比在实际产品中容易,所以使用培养基进行生产,其无菌风险远大于正常生产,不仅可用于评价生产工艺对产品无菌保证的有效性和稳定性,还可用于验证人员的无菌操作能力。国家药品监督管理局药品审评中心在对企业的APS 检查中也提出 ,相关企业在人员的培训与操作方面问题较大。因此,非常有必要对人员在无菌隔离器内的操作进行验证。
为保证该验证的普遍适用性,本研究对验证中的人员在无菌隔离器内的操作行动进行规范。在APS 验证中,人员需在无菌隔离器内进行“1.1”项下所述的干预操作,包含生产过程中可能涉及的所有操作,具体操作内容如表 1、表 2 所示。
在整个 APS 验证过程中,按 GMP 要求采用最差的灌装条件,并且对无菌工艺模拟生产的培养基产品进行促生长试验,保证操作人员的任何不规范操作均会反映在培养基产品上。同时,对无菌隔离器内 A 级环境和无菌隔离器所在的 C 级背景环境按正常生产频率进行动态环境监测,监测项目为沉降菌、浮游菌、悬浮粒子和表面微生物。此外,及时记录洁净区之间的压差、温度和湿度,通过环境监测结果和培养基产品的培养结果来验证人员在无菌隔离器内的操作是否规范。

在无菌隔离器内的设备处于正常生产状态且人员在各个岗位上进行模拟干预操作的条件下,由相关验证人员完成气流流型测试。验证人员应根据实际情况,选择无菌隔离器内的流型测试点,确保人员在无菌隔离器内的模拟干预操作均在烟雾气流下方。气流流型测试动作节选如图所示,人员在无菌隔离器内进行操作时,无菌隔离器内的单向流没有发生改变,未产生紊流现象,且与静态测试相比,气流流型相同,则说明人员在无菌隔离器内的操作规范,不会对无菌隔离器内的环境产生影响,进而影响产品质量。
无菌隔离器在生产前会进行清洁、消毒、灭菌,以保证设备运行前无微生物污染,不会对验证结果产生影响。

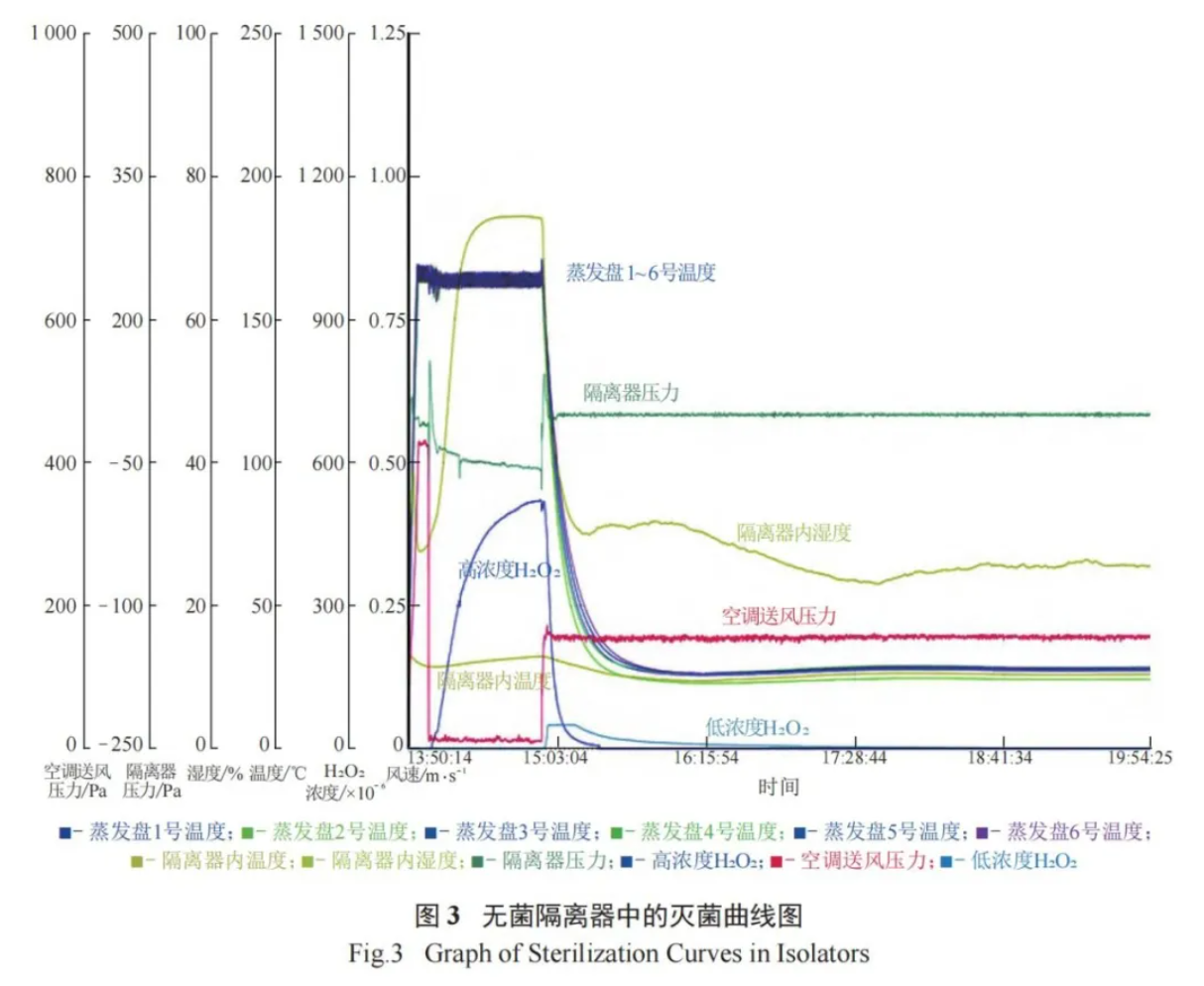
对无菌隔离器内的固定设备和手套等采用异丙醇进行喷雾和擦拭,以对其表面进行清洁和消毒。无菌隔离器内的灌装压塞机需进行泄漏检测,检测合格后,进行在线高温湿热灭菌 (121 ℃,30 min)。随后,将设备运行过程中所需的辅助器具 ( 如不锈钢条和培养皿等物品 ) 经预处理后放置于无菌隔离器中。按无菌隔离器验证的装载示意图定点放置后,对无菌隔离器进行泄漏测试,测试合格后,采用经第三方机构通过对无菌隔离器内的过氧化氢浓度以及生物指示剂的挑战验证得出的灭菌运行参数( 预处理 10 min、充气 15 min、保压 40 min、通风120 min) 进行灭菌,通风至过氧化氢浓度降至 10–6以下,然后对过氧化氢灭菌曲线与岗位标准操作规程模板曲线进行审核,确保灭菌效果达到要求。过氧化氢灭菌曲线见如图 3。
APS 过程在 C 级洁净区背景下的无菌隔离器 A级洁净区环境中进行。操作人员按表 1 和表 2 所示模拟方法进行干预操作,并记录每项干预操作的次数和时间。整个过程通过摄像设备记录,动作节选如图4所示,操作人员通过手套箱操作时,动作干净、移动缓慢且稳健。

在 APS 全程中进行沉降菌、浮游菌、悬浮粒子和表面微生物的监测。沉降菌、浮游菌和悬浮粒子的采样点确定与评估见表 3,监测标准严格遵守GMP 规定 ( 见表 4)。
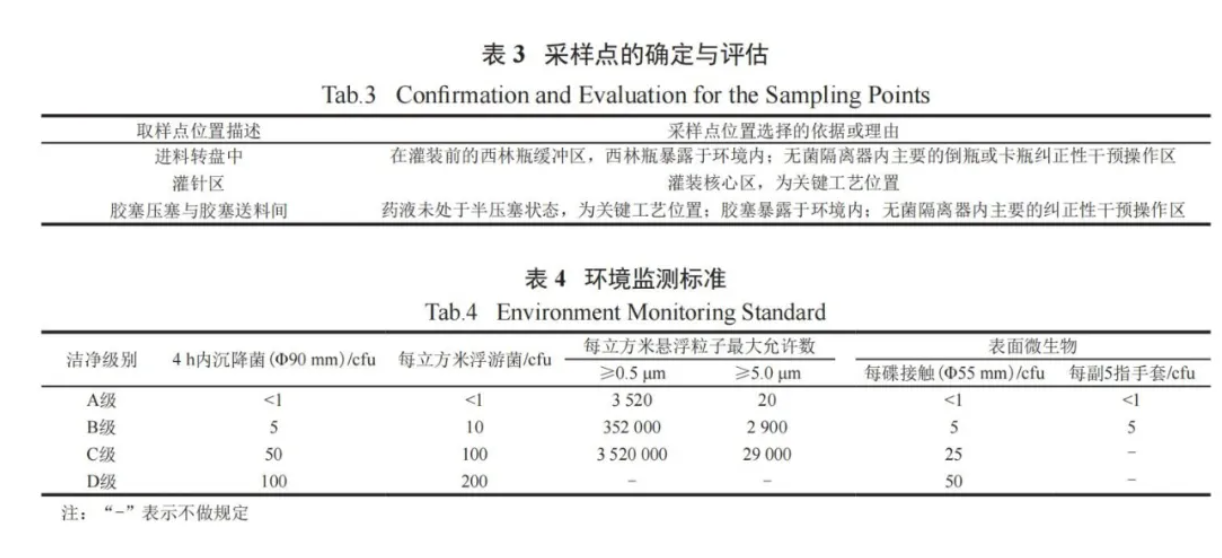
表面微生物的监测除设备表面、无菌隔离器手套表面外,还包括人员监测 ( 如人员穿戴的洁净服表面和人员佩戴的手套表面等 ),进一步对人员在无菌隔离器内的操作规范性进行限制。监测结果表明,整个模拟过程中微生物的污染水平未超过法规规定的限度,证明人员在无菌隔离器内的操作不会对环境造成影响。除此之外,整个APS过程中,风速、压差和温湿度等监测结果均符合相关法规要求,监测记录曲线见图 5。
如果您对于无菌隔离器气流流型验证、浮游菌、悬浮粒子和表面微生物的监测有疑问,可以与北京中邦兴业技术工程师联系,为您提供专业解答。















