
洁净室认证是一个验证过程。该验证过程证明洁净室操作条件符合预期设计参数。根据当前洁净室标准,使用便携式粒子计数器在洁净室周围均匀间隔的测试位置以规定的体积取样,测试房间粒子计数。最被接受和广泛使用的洁净室标准是ISO 14644-1(2015)《洁净室和相关受控环境——第1部分:按颗粒浓度分类的空气清洁度》。

ISO 14644-1规定了最小样本数量、根据洁净室分类在每个样本点采集的样本体积以及0.1至5.0微米之间的相关颗粒尺寸。在生命科学制造设施中,无菌处理在ISO 5洁净室中进行,监测和报告0.5µm,预期数据为5.0µm;然而,在新的ISO-14644-1(2015)更新中,基于ISO 5环境中的低浓度和粒子计数器系统中的潜在粒子损失,不再需要报告5µm。但在2015年更新之前,该行业仍继续报告5µm,这已成为常态,其他GMP标准仍要求监测5.0μm颗粒。下表列出了用于确定洁净室分类的最大允许颗粒数。
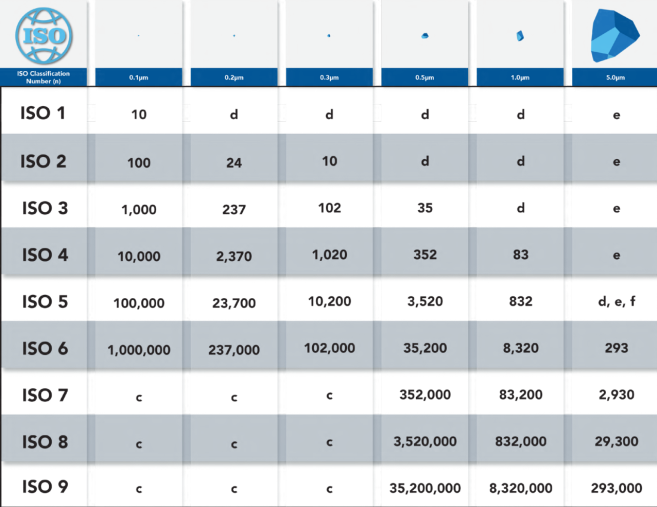
对于洁净室内的采样点数量,新的ISO 14644-1(2015)更新取消了基于洁净室面积平方根的旧计算方法,取而代之的是基于洁净室尺寸的表格。然后可以从下表中确定最小采样点数量。

(ISO 14644-1:2015样本位置数量表)
在洁净室分类中,设置便携式粒子计数器以获取一立方米的样本体积,并将位置ID插入程序中,以便识别和记录与该位置相关的数据。粒子计数器固件中的报告功能可以在洁净室内采样结束时确定粒子浓度是否在可接受的浓度范围内。
因此,洁净室认证是一个公式,当应用时,根据立方米样品中允许颗粒的可接受限值提供确定结果,该限值可参考图1中的上表。随着粒子计数器仪器技术的改进,现在每个位置采样立方米的最快时间为10分钟。每个样本位置使用一个便携式装置,在达到所需样本体积后,操作员手动将粒子计数器带到每个位置。
日常监控是在制造过程开始时进行的过程。这与洁净室认证(配方)完全不同,例如,在ISO 5环境下的传统灌装完成无菌过程中,灌装机使用多个远程颗粒计数器。颗粒计数器采样点的位置基于cGMP指南,应通过风险分析过程确定。该风险分析应基于良好的科学和对无菌制造过程的充分理解。简单地说,当使用灌装机作为示例时,“风险”位置将被确定为灌装机沿线产品可能存在风险的区域,例如当打开的小瓶或部分塞住的小瓶沿工艺线移动时。
使用沿灌装线的便携式颗粒计数器对这些位置进行真实鉴定将确定颗粒浓度最高的位置。这是基于HEPA空气系统的输送、灌装机的物理设计、关键区域的气流以及关键区域周围空气湍流的控制,特别是在小瓶和安瓿打开(加盖之前)的情况下。FDA的无菌处理指南(2004)预计采样点在“关键区域”一英尺以内。通过遵循风险分析过程,确定临界区将大大有助于确定。附录20,ICH Q9提供了风险分析过程的指导。
灌装线沿线的大多数位置通常位于灭菌炉的小瓶入口处、储液器处、灌装头和塞子/封盖位置附近,以及冷冻干燥机的运输位置,以及运输至冷冻干燥机的内部。典型的灌装线可能有6-7个样本位置,然后结合ISO 7位置进行监控(灌装线所在房间内的背景位置)。

(远程颗粒传感器持续监测0.5µm和5.0µm颗粒浓度)
远程粒子计数器连接到实时监控软件,实时监控每个位置,如果任何位置的粒子浓度超出正常预期操作限值,则通知操作员和管理层。
总之,洁净室认证是一个公式驱动的过程,用于确定特定时间内多个位置的样品体积是否具有较低的颗粒计数期望值,以确定洁净室是否在设计条件下运行。该过程的结果验证了洁净室符合一定的清洁度水平。该验证正在进行中,重新进行的测试基于ISO 14644-2中规定的洁净室分类。常规监测是一个单独的过程,样本位置和警报配置基于过程知识、良好科学和正式的风险分析方法。在GMP指南中,认证和常规监测有着明确的分离。附件1明确界定了认证和监测之间的区别。















